- 【通用名称】
- 【英文名称】
- 【商品名称】
- 【成份】
- 【规格】
- 【适应症】
- 【用法用量】
- 【安全用药】
- 【禁忌】
- 【注意事项】
- 【药理作用】
- 【药代动力学】
- 【毒理研究】
- 【临床试验】
- 【上市许可持有人】
- 【生产企业】
- 【其他】
注射用全氟丁烷微球
示卓安 SONAZOID
示卓安 SONAZOID
本品主要成分为全氟丁烷微球,主要含全氟正丁烷和少量全氟异丁烷,辅料:氢化卵磷脂酰丝氨酸钠和蔗糖。
化学名称:1,1,1,2,2,3,3,4,4,4-十氟丁烷。
全氟正丁烷化学结构式:
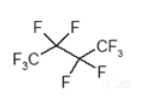
全氟异丁烷化学结构式:
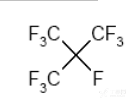
分子式:C4F10
分子量:238.03
每个包装盒内装有注射用全氟丁烷微球 1瓶,附带溶剂(灭菌注射用水)1支和无菌液体转移器 1个。
每瓶中含微球的体积为16ul
本品仅用于诊断使用;
注射用全氟丁烷微球是一种超声造影剂,用于肝脏局灶性病变血管相和 Kupffer
相的超声成像。
本品仅供静脉给药,应由医生或其它有资质的医护人员使用。
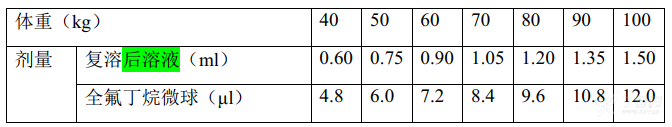
成人常规用法:一瓶(16μl)全氟丁烷微球,用随附注射用水 2 ml复溶,制成 0.015 ml/kg的复溶后溶液供静脉给药(见配制方法)。复溶后溶液应在配制后 2小时内使用。
临床推荐剂量为 0.12μl全氟丁烷微球/kg体重。不同体重的常规用量参见下表。
患者在开始注射本品前须进行超声成像,本品给药后即刻的血管相造影效果最佳。注射后须立刻用 5~10 ml 0.9%
氯化钠注射液冲洗静脉给药管路,确保造影剂完全注射。
一般情况下,成人一天一次即可(无重复给药经验)。
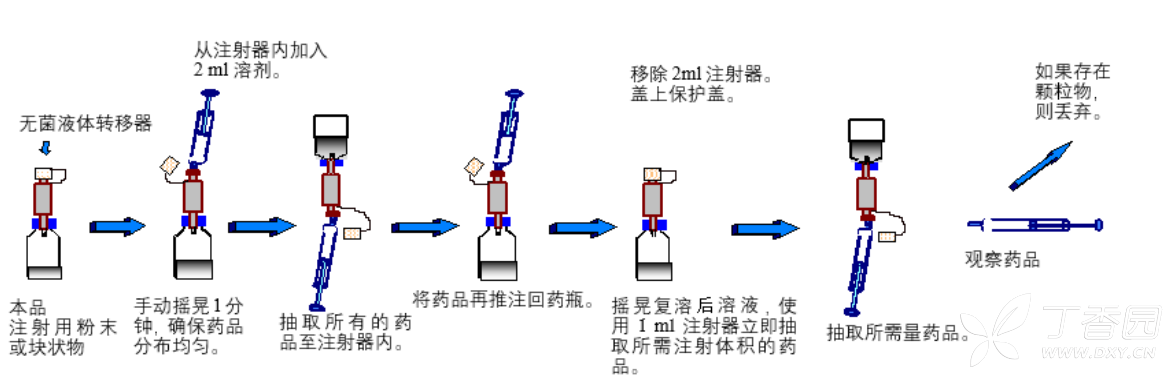
配制方法
使用随附的无菌液体转移器将将随附的注射用水推注到药瓶内配制复溶溶
液并将复溶后溶液抽到注射器内。复溶后溶液抽到注射器和推注回药瓶时,应缓慢操作,避免过度减压和加压。除所附的注射用水外,本品不得与其他药品混合,使用随附的注射用水以外的溶剂可能导致聚合物形成。
打开随附注射用水的包装:拧开安瓿前,用酒精消毒棉球擦拭安瓿,以免污染。
用一个空注射器抽取 2 ml
注射用水。
将随附的无菌液体转移器插入药瓶(冻干制剂)。
将含注射用水的注射器与无菌液体转移器相连,把 2 ml注射用水推注至药瓶。随后,在不取下注射器的情况下,立即摇晃药瓶 1分钟。
因部分注射用水仍残留在无菌液体转移器内,因此,抽取全部复溶后溶液至注射器,然后再推注回药瓶。
将抽取复溶后溶液的注射器与无菌液体转移器相连,抽取所需剂量的复溶后溶液。
无菌注射用水安瓿使用指南
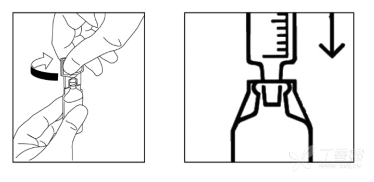
旋转拧开安瓿瓶
无需连接针头,将注射剂直接插入安瓿
本品的复溶和抽取示意图:
孕妇及哺乳期妇女用药
仅当确定基于诊断的获益超过风险时,才可对孕妇或育龄妇女使用本品(尚未确定妊娠期间使用本品的安全性)。
本品不应用于哺乳期妇女。如果必须用药,则应中止哺乳(尚未确定哺乳期间使用本品的安全性)。
本品中任何成分有过敏史的患者禁用本品。
检查前
使用前,检查确保产品包装密闭、容器完整未破损。
应始终考虑发生超敏反应的可能性,包括严重、危及生命的类过敏反应/类过敏反应性休克。应准备好抢救设备。
本品含有一种来源于鸡蛋的表面活性剂(氢化卵磷脂酰丝氨酸钠)。对于有蛋类或者蛋类制品过敏史的患者而言,只有当受益明显大于潜在风险时才可使用本品。
右向左右向左分流型心脏病或肺内分流患者应慎用,因为在这类患者中,本品会不流经肺而直接进入血液循环。
心脏状况不稳定或严重冠状动脉疾病患者应密切观察,严重肺病患者应慎用,因为本品主要经肺排泄。
检查前:使用本品进行超声检查当天,应避免进行消化系统检查(例如腹腔镜检查或使用发泡剂的钡餐试验)。
给药
使用针头规格不小于 22 G。
静置后可能产生复溶药品的分层,应在给药前摇晃药瓶,以确保混悬液均匀后立即给药。
本品给药后,通常应立即使用少量等渗氯化钠溶液(ISCS)冲洗给药管路。开启后,药瓶内的药品仅供单人使用,须丢弃剩余药品、剩余注射用水和使用后的无菌液体转移器。
超声扫描
本品的造影效果包括给药后即刻的血管相和给药后约 10分钟的 Kupffer相 (肝实质增强)。为保证理想的 Kupffer相成像效果,应在血管相之后暂停检查操作以避免微球破裂。如肝脏局灶性病变仍具有 Kupffer细胞,建议结合造影前常规图像以帮助诊断。
药效学特性
药物治疗学分组:超声造影剂
ATC编码:V08 DA
本品中的活性成分是 PFB(全氟丁烷)微泡,静脉注射后能够穿过肺毛细血管床流到左侧心腔,随后循环至全身。发射的超声波被微泡表面有效地反向散射,因而增强管腔内血液和周围组织对比度。
诊断肝脏病变时,给药后一分钟内可立即观察病变及其周围血管影像,进行鉴别诊断(定性诊断)。另外,本品中的部分微球在给药后 5~10分钟被网状内皮系统摄取(对于肝脏来说是 Kupffer细胞),因而增强了正常组织与没有网状内皮系统的恶性病变之间的对比。使得 Kupffer相影像尤其有助于病变的定性诊断和探查。
0.12 µL MB/kg(临床剂量)和 0.60 µl MB/kg(作为混悬剂,分别为 0.015 ml/kg和 0.075 ml/kg)剂量的本品单次静脉内给予健康成人后,血液中 PFB的浓度迅速降低。在 0.12 µL MB/kg剂量组中,在注射药物后仅前 10至 15分钟时观察到 PFB浓度高于定量限(LOQ)。在 0.60 µL MB/kg剂量组中,在静脉推注(p.i)后 60分钟,观察到高于定量限(LOQ)的 PFB浓度,曲线形状显示为双相消除特征。0.60μLMB / kg剂量组的消除半衰期为 17.0±7.7分钟。对于 0.12 µL和 0.60 µL MB/kg剂量组,血液中 PFB的平均 Cmax值分别为 2.3±1.1 ng/g
和 19.1±9.2 ng/g。
给予的 PFB经呼出的气体排泄。在两个剂量组中,均在单次 IV给予药品后不久观察到呼出气体中 PFB浓度达最高。此后,浓度迅速且呈双相下降,与血液 PFB水平的下降一致。对于 0.12 µL和 0.60 µL MB/kg剂量组,呼气中 PFB的平均 Cmax值分别为 0.35±0.2 ng/mL和 2.4±0.7 ng/mL。对于两个剂量组,消除半衰期相似,0.12 µL和 0.60 µL MB/kg剂量组消除半衰期分别为 21.4±8.0分钟和 22.0±4.8分钟。在 0.12 µL MB/kg剂量组和 0.60 µL MB/kg剂量组中,分别在给药 16分钟后和给药 61分钟后,PFB的平均浓度降至 LOQ以下。
在中国成人中观察到的药代动力学特征与高加索人和日本成人的数据相当。
临床前安全性数据
根据非临床药理学安全性研究,包括重复给药毒性、给药毒性和生殖毒性常规研究,均显示本品不会对人体产生特殊危害。
在大鼠重复给药研究中,观察到所有剂量组的动物都出现一过性炎症。在大鼠单次给药研究中没有观察到相似结果,在剂量≥ 200
倍临床推荐剂量单次或重复给药的犬研究中,也没有观察到相似的结果。基于临床推荐剂量,认为肺部结果具有极小临床相关性。
本品和对照药静脉注射后,一些大鼠和小鼠品系发生肠道的盲肠和回结肠区的重度炎性/坏死病变。在犬中观察到更轻度的反应。
已阐明这些病变的机制且不认为该机制对人体构成风险。在注射其他的超声造影剂时,在小鼠和大鼠中也观察到了同样的病变,因此这被认为是"类效应"。
在 GE045-002研究中,218例受试者中 7.3%的受试者出现了治疗中出现的不良事件(TEAE),且大多数为轻度(与对照药之间无差异)。
3.7%的受试者出现被怀疑由 IMP给药引起的 TEAE(与对照药之间无差异)。本研究中未发生死亡或 SAE。
根据研究者对变化的判读,无受试者发生生命体征相对于基线的有临床意义的变化。
GE Healthcare AS
GE HEALTHCARE AS
是否OTC:否

